双抗在颤抖,FDA《双抗研发指南》来了
发布时间:2021-5-27 13:37阅读:230
2021年5月24日,FDA发布《双特异性抗体研发指南》定稿版本。
在临床研究方面,FDA强调了,如果#同靶点单抗# 已经上市,必要时候需要#头对头# 对比单抗的疗效与安全性,以更有效的进行获益-风险评估。

这就好玩了。
默沙东的K药就是标杆,国内这一大堆生物制药公司的双抗,要想在美国上市,必须要做头对头对照试验,才能可获取——肺癌或者黑色素瘤大适应症。
不仅仅是临床试验成本会高得吓人,而且会面临失败的风险。
例如,$康宁杰瑞制药-B(09966)$ 的KN046(PD-L1/CTLA-4双抗)2期单臂临床试验,81例患者疗效可评估,(共入组51例非鳞癌患者,36例鳞癌患者)。
客观缓解率ORR=50.6%,疾病控制率(DCR)达87.7%,中位PFS=5.9个月,中位OS未达到。
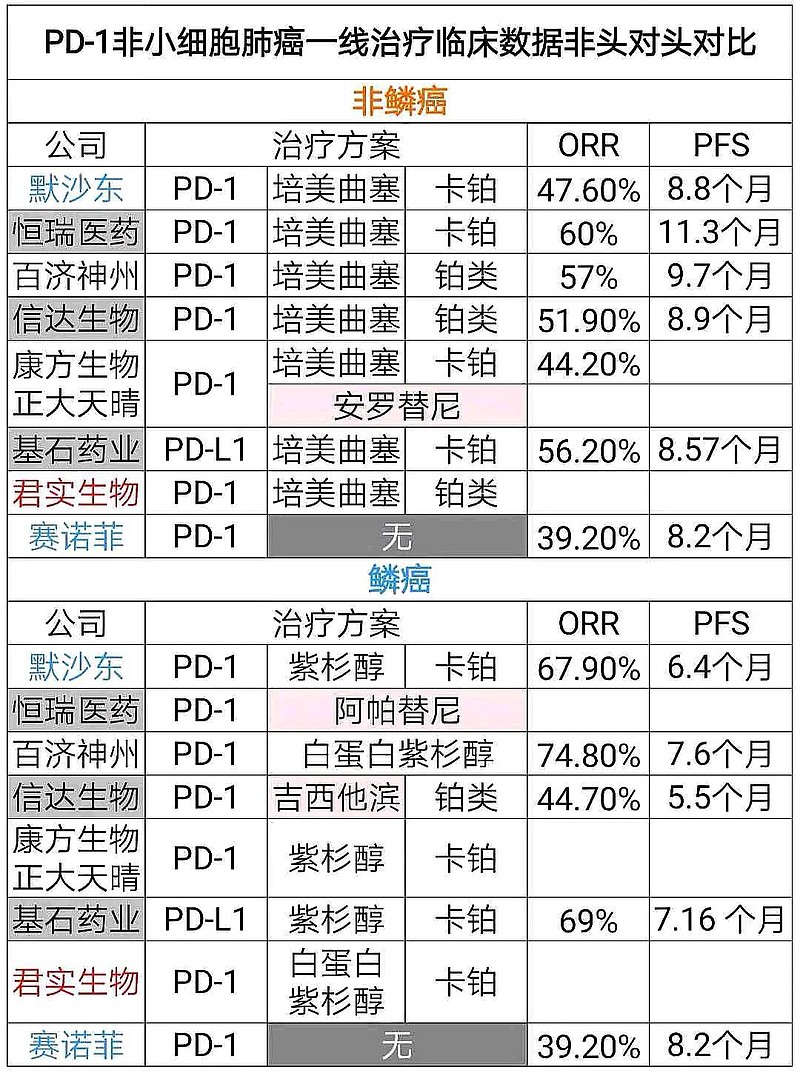
与已经在中国开展的PD-1或者PD-L1的3期临床数据比较,直观感受是:
康宁杰瑞PD-L1/CTLA-4双抗没有任何优势。
再来看看,$康方生物-B(09926)$ 的AK104(PD-1/CTLA-4双抗),在ASCO2021,公布了AK104联合仑伐替尼肝癌一线的2期临床试验数据。
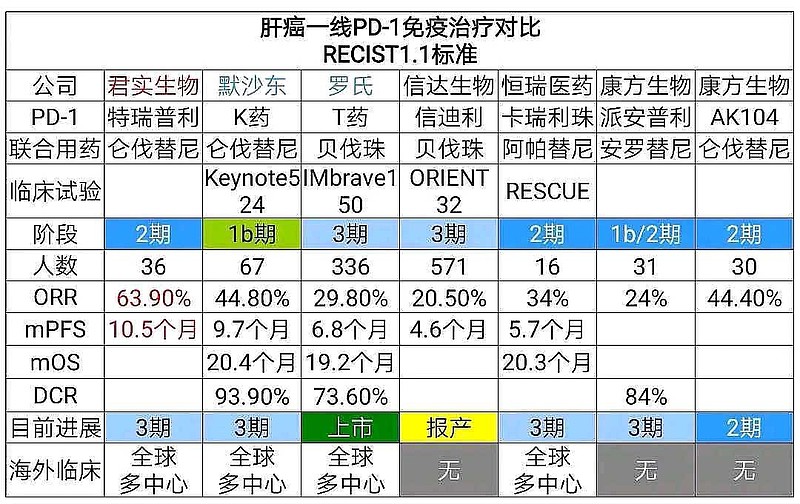
与$君实生物-U(SH688180)$ 的PD-1联合仑伐替尼+HAIC比较,与默沙东的K药联合仑伐替尼比较,
康方生物的AK104联合仑伐替尼客观缓解率ORR,没有任何优势。
那么,问题来了,生产成本更高的双抗,研发前途是不是高风险?
温馨提示:投资有风险,选择需谨慎。
-
最新整理:2026全年A股休市日历出炉!
 2026-01-12 13:33
2026-01-12 13:33
-
2026年"国补"继续,核心变化有哪些?哪些板块&指数机会更大?
 2026-01-12 13:33
2026-01-12 13:33
-
2026A股16阳后,春季行情如何合理布局?
 2026-01-12 13:33
2026-01-12 13:33



 问一问
问一问
 +微信
+微信
 分享该文章
分享该文章










